LC50 Para metales como indicador de calidad de agua.
Acuicultura en Chile.

Carlos Alberto Pessot
Director en Aquaknowledge
Una de las causas de bajos rendimientos o deficiencias productivas, en etapa de producción de agua dulce, más presentes en la industria acuícola del salmón en Chile tiene su origen en la presencia de metales de origen natural tanto en cuerpos de agua dulce superficial como pozos profundos. La toxicidad de metales como Aluminio y Cobre entre otros ha sido descrita con anterioridad (1, 2, 3, 4, 5) y su presencia en aguas naturales de nuestras zonas productivas, se debe a las características de la matriz geológica muy rica en minerales solubles. Antecedentes existentes a la fecha indican que junto a los factores geológicos antes indicados, el clima y la actividad sísmica juegan un rol fundamental en la dinámica de la composición fisicoquímica del agua (6) y consecuentemente de variabilidad productiva. La inestabilidad de las aguas naturales en Chile, no solo se manifiesta como cambios en la composición de metales, sino también en las concentraciones de otras variables fisicoquímicas que modulan su toxicidad. Entre estas podemos identificar, entre otros, pH, Alcalinidad, Ca++, Mg++, Na+, Cl-, Carbono Orgánico Total (COT), SO4= (7). La condición anterior produce limitaciones al momento de interpretar los niveles de metales en el agua (tanto para pisciculturas de flujo abierto como de recirculación) en un marco de salud de peces. Como consecuencia, el uso de concentraciones absolutas de metales sin considerar los parámetros moduladores antes mencionados, produce el riesgo de descartar cuerpos de agua dulce utilizables, validar el uso de cuerpos de agua dulce con riesgo, identificar condiciones de toxicidad cuando no las hay y/o descartar condiciones de toxicidad cuando estas si han estado presentes. Lo anterior incluyendo también el riesgo de no identificar causas para corregir el funcionamiento de sistemas productivos y/o evitar fallas de diseño. En este contexto un aspecto relevante que guarda relación con la interpretación de estas variables, son los sistemas de recirculación donde al efecto de los parámetros ya mencionado, se adiciona el efecto de biomasas fijas (COT) y la dinámica de variables de origen metabólico que inciden sobre la condición fisiológica de los peces (8). Lo anterior hace el análisis aún más complejo, siendo necesaria la capacidad de consolidación de datos en índices interpretables.
Este trabajo muestra seguimientos realizados en el tiempo sobre cuerpos de agua dulce utilizando los criterios de LC50 para metales como Aluminio, Cobre y Zinc, demostrándose que dichos índices resultan una herramienta de utilidad y presentándose como una alternativa necesaria en el contexto de la evaluación de calidad de agua para producción de peces en etapas de agua dulce (flujo abierto y recirculación) en la acuicultura en Chile.


Desarrollo:

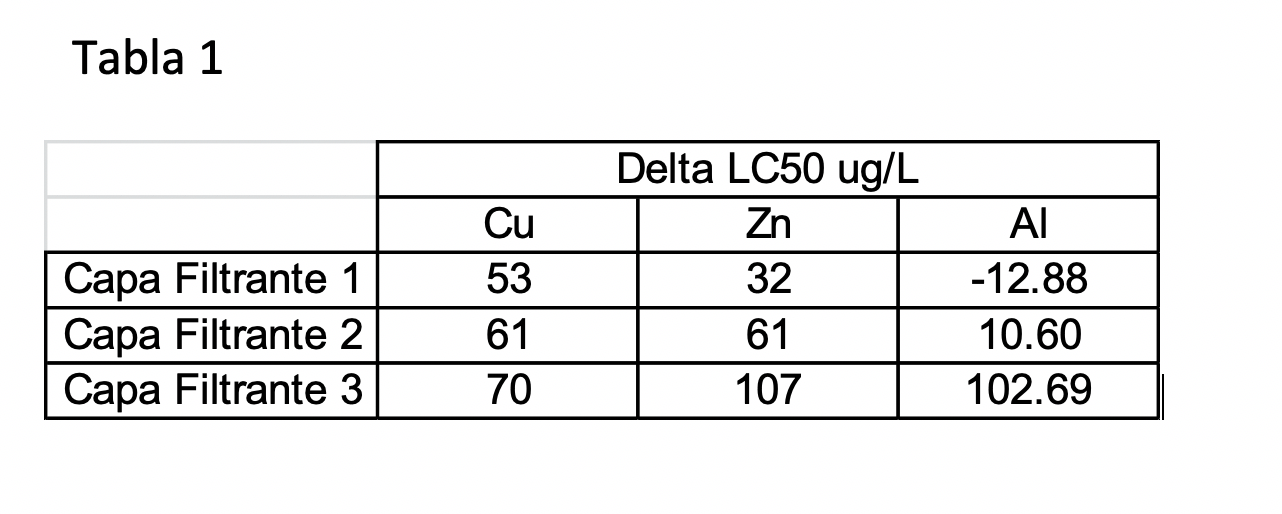
Tabla 1. Indica las variables utilizadas en los algoritmos para cálculo de LC50.
El presente muestra resultados de alguno de los seguimientos realizados por Aquaknowledge, en el contexto del monitoreo de calidad de agua para instalaciones de producción de peces de agua dulce (Flujo abierto y recirculación). Estos seguimientos han sido realizados tomando muestras con una frecuencia mensual o bimensual dependiendo de las características del cuerpo de agua y han incluido, entre otras, las variables que se indican en la tabla 1 (Abajo). Estas variables han sido establecidas en base al requerimiento de datos de los algoritmos utilizados para determinar los índices antes descritos, como son LC50 (Concentración Letal 50) y CC5 (Concentración con efecto Crónico, este último para ser aplicado en el caso de Aluminio). Para el caso del Cobre y Zinc estos algoritmos corresponden a adaptaciones del modelo de ligando biótico (4) (BLM) para aplicación en las especies de interés en la industria acuícola en Chile. Y para el caso del Aluminio, la aplicación de un algoritmo establecido por Aquaknowledge en base a información de seguimiento de calidad de agua en sistemas productivos y casuística observada.
La figura 1 muestra el seguimiento de un cuerpo de agua superficial en el que se grafican la tendencia de la concentración de Cobre y la tendencia del nivel del LC50 para este metal. Efectivamente, la fluctuación del potencial tóxico de un metal en el contexto de la realidad local (áreas productivas de agua dulce en la industria acuícola en Chile) es extremadamente amplia, observándose en este caso, para un mismo cuerpo de agua momentos en que un nivel por sobre por sobre 10 ug/L puede ejercer un efecto tóxico y otros momentos en que se requiere una concentración por sobre 189 ug/L para producir el mismo efecto. De la misma forma para el caso del Zinc, las fluctuaciones de composición fisicoquímica en el agua muestran grandes variaciones en los límites tóxicos (LC50) para este metal.

Figura 1. Muestra la tendencia del LC50 para Cobre (línea verde) y la concentración real de Cobre (línea roja) sobre un período de monitoreo de aproximadamente 10 meses.
La figura 2 corresponde al seguimiento del mismo cuerpo de agua antes indicado, esta vez mostrando el LC50 para Zinc y su concentración efectiva. Para el caso de este metal los LC50 mínimos y máximos observados respectivamente, son 23 y 125 ug/L. Es posible observar que las fluctuaciones son similares entre un metal y otro dado que los efectos de cada variable considerada en el algoritmo, se basa en mecanismos fisicoquímicos iguales.
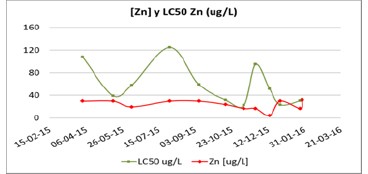
Figura 2. Muestra la tendencia del LC50 para Cobre (línea verde) y la concentración real de Cobre (línea roja) sobre un período de monitoreo de aproximadamente 10 meses.
Figura 1. Muestra la tendencia del LC50 para Cobre (línea verde) y la concentración real de Cobre (línea roja) sobre un período de monitoreo de aproximadamente 10 meses.
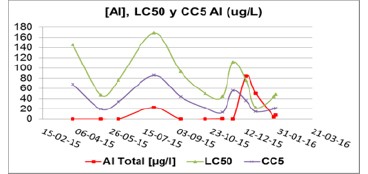
Figura 3 Muestra la tendencia del LC50 para Cobre (línea verde) y la concentración real de Cobre (línea roja) sobre un período de monitoreo de aproximadamente 10 meses.
Para el caso del Aluminio, fuera de graficar el LC50 y la concentración efectiva de este metal, también se incluye el CC5 (figura 3).