Potencial causa de mortalidad por metales e hidrógeno sulfurado en pisciculturas de recirculación.

Carlos Alberto Pessot.
Director en Aquaknowledge
La presencia de volcanes y erupciones (116 en 100 años1) en el sur de Chile ha generado estratos geológicos ricos en minerales. Las cenizas volcánicas tienen alto contenido de aluminio (Al) (24 – 28% exceptuando oxígeno) (Taylor y col., 1980; Naranjo y Stern, 2004), y el suelo y el agua de la región presentan altos niveles de este metal. Las formas de Al incorporadas como óxido de aluminio (Al2O3) por cenizas, sufren cambios de conformación química en el tiempo en los estratos geológicos y también por contacto con el agua (Hem y Roberson, 1967). Así se forman estructuras amorfas con constantes de hidrólisis extremadamente bajas (1,93 x 10-13) semejantes a bohemita y con comportamientos anfóteros respecto de su solubilidad. En forma de partículas, y también coloidal (disueltas en aguas de hidratación) tienen tamaños que superan 0,45 um de diámetro (Hem y Roberson, 1967). Con constantes de hidrólisis extremadamente bajas y diámetros moleculares muy grandes, es crítico (para determinar en forma cuantitativa y confiable la concentración de Al total) realizar, antes de cuantificar, una hidrólisis muy enérgica para obtener un 100% de Al en forma de Al3+. Dicha hidrólisis, requiere acidificación fuerte y tratamiento térmico. Una muestra solo acidificada y filtrada (membranas de 0,22 y 0,45 um) retiene partículas conteniendo Al (Figura 3). Esta condición explica una subestimación histórica de los niveles de Al en aguas de origen natural en la industria salmonicultora chilena. Estos antecedentes son de gran importancia debido a que el efecto del Al en cuerpos de agua natural (Chile) ha sido históricamente subestimado. Tampoco se ha identificado el verdadero efecto y mecanismo de mortalidad en etapas tempranas de desarrollo de los peces. Esta es una revisión bibliográfica que incorpora investigación y proyectos de Aquaknowledge, abordando las causas de subestimación de Al y, en menor grado, otros metales; presenta hallazgos demostrando que las mortalidades en pisciculturas chilenas por Al, no tienen como sitio blanco principal la branquia, sino riñón; y que juegan un rol importante los factores de tipo acumulativo.
https://ignopal.wordpress.com/2016/02/25/chile-un-pais-volcanico

Aluminio no removido por filtración, en porcentaje.
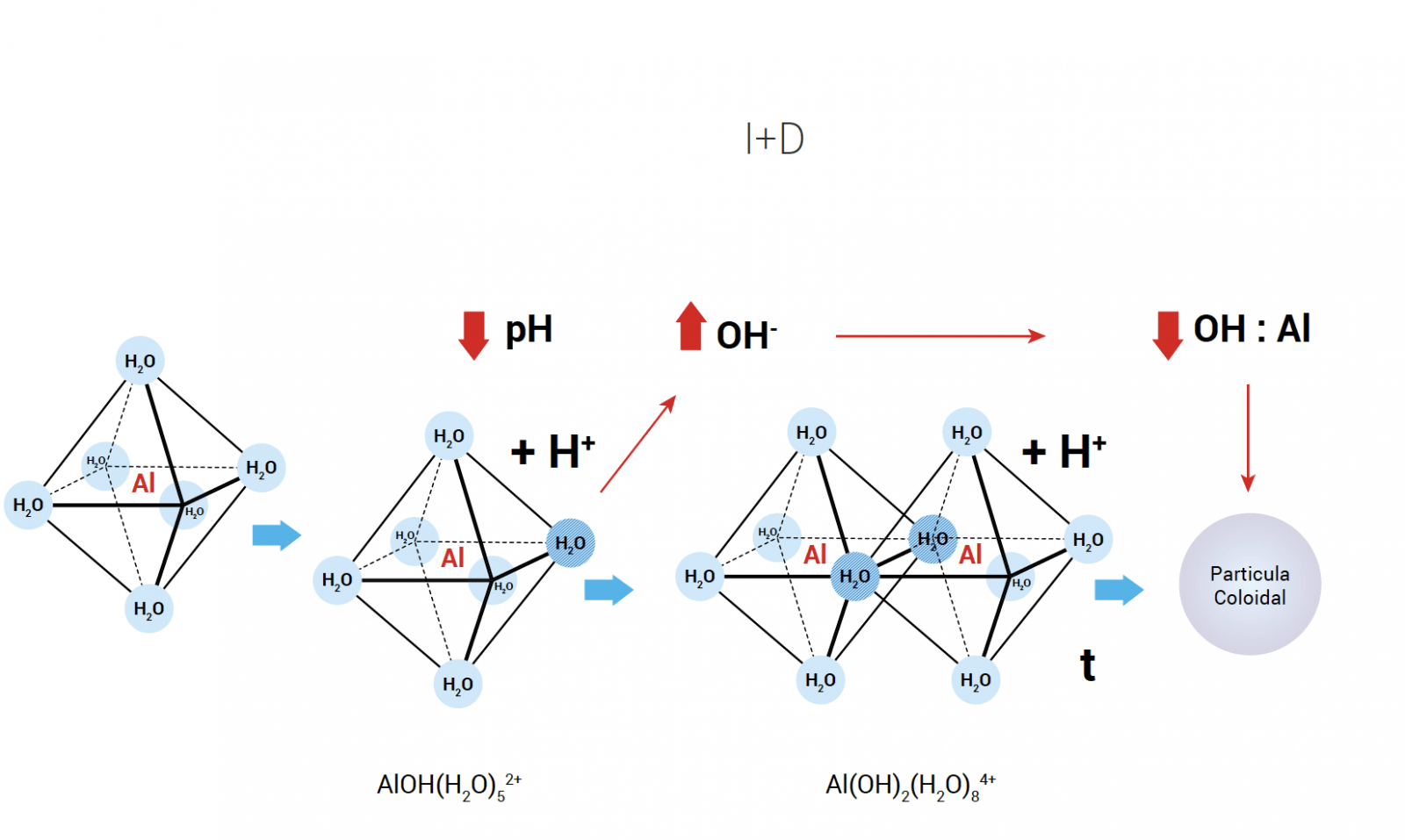
Figura 1. Dinámica de formación de estructuras coloidales de aluminio en función del pH y presencia de iones Hodroxilo. Fuente: adaptada de Hem y Roberson, 1967.
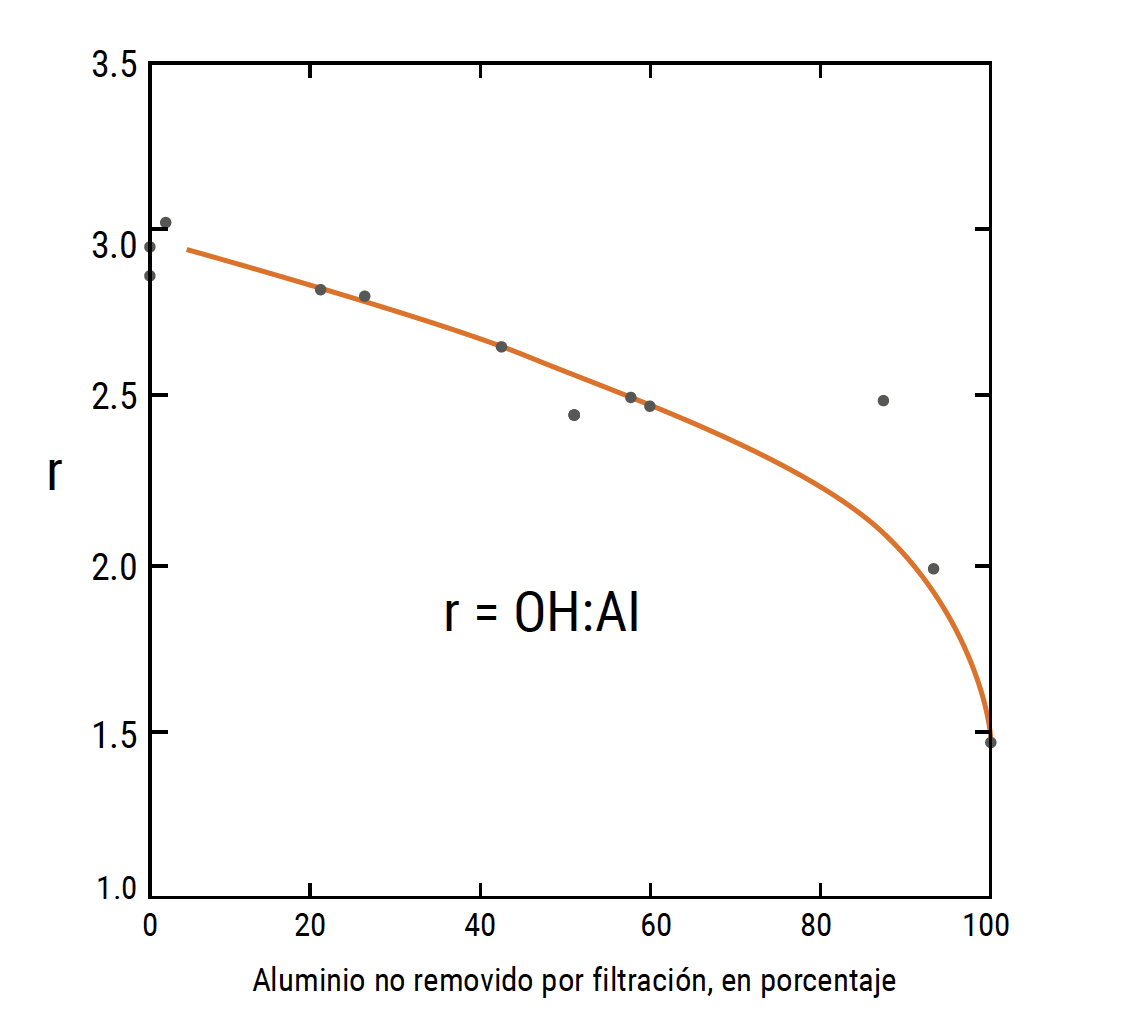
Figura 2. Porcentaje de aluminio retenido de una solución acuosa
por filtración a través de membranas de 0,1 um.
Técnicas de análisis de factores relevantes para una correcta cuantificación de aluminio.
Los procedimientos analíticos tienen básicamente dos etapas:
A) Extracción o procesamiento de la muestra
B) Detección del compuesto o elemento que se medirá En muestras de agua, la primera etapa, es crítica.
El Al forma estructuras complejas que deben ser hidrolizadas antes de la etapa de detección. La Figura 1 muestra la dinámica de formación de estructuras coloidales de aluminio.
Las estructuras coloidales y minerales (Santore y col., 2018) no se hidrolizan con tratamientos ácidos simples. Aquellas técnicas que aplican membranas de ultrafiltración, pueden generar resultados subestimados de la concentración de aluminio, quedando parte retenido en la membrana del filtro. La subestimación puede ser sistemática llegando a no detectar por sobre el 50% del Al total contenido en el agua (Pessot 2017a,b). La Figura 3 muestra un ensayo comparando el resultado de una muestra acidificada y ultrafiltrada vs la misma muestra acidificada sin ultrafiltrar. Esto (ensayo realizado en Aquaknowledge), muestra que el efecto de ultrafiltrar produce una subestimación del resultado de un 31%.
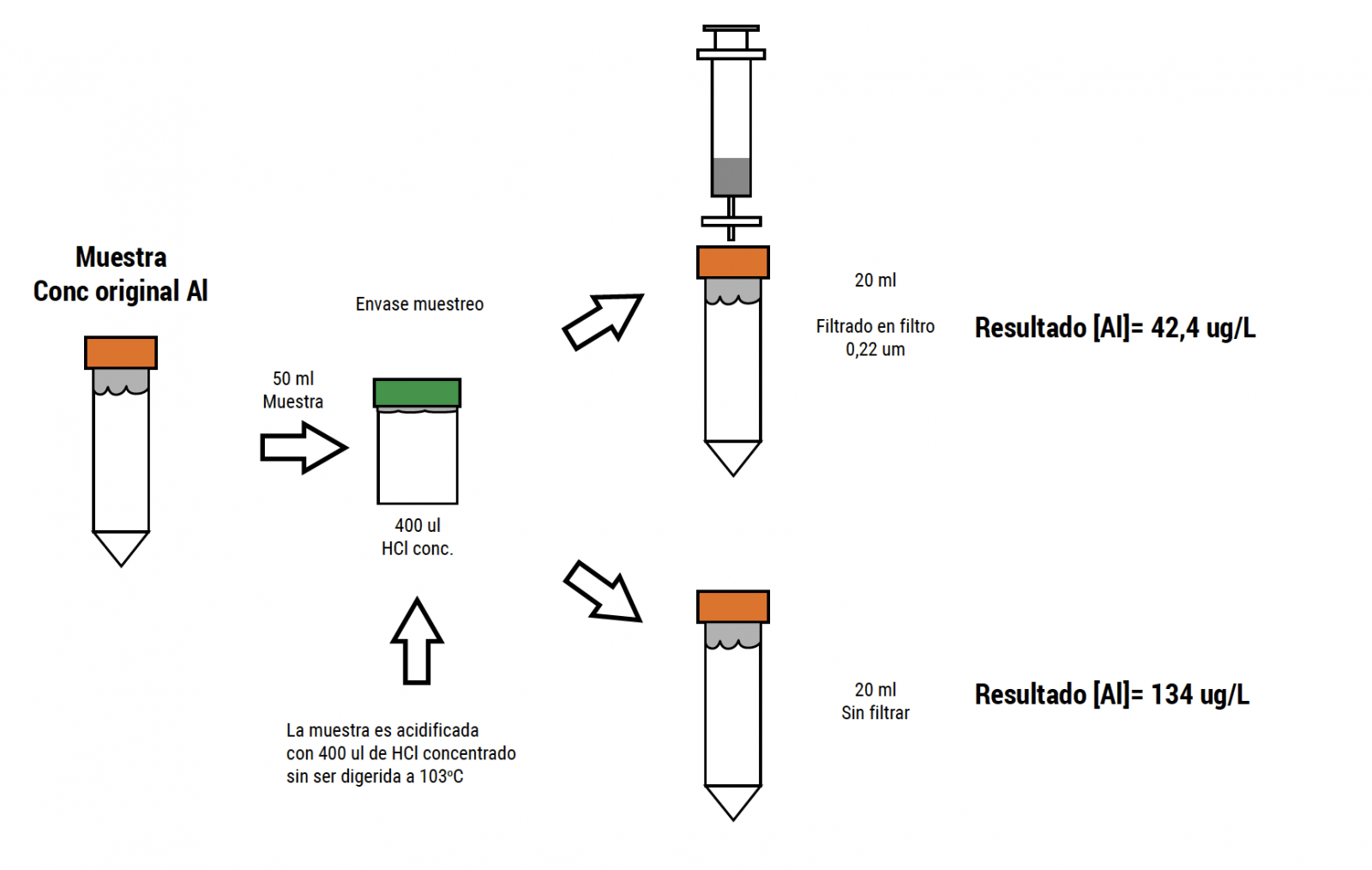
Figura 3. Esquema de ensayo que compara el resultado de una muestra acidificada y ultrafiltrada vs la misma muestra sin ultrafiltrar..
Respecto de la segunda etapa del procedimiento analítico de agua, existe mayor grado y opciones de tecnología. Es importante recalcar que la primera etapa tiene mayor efecto sobre la alteración del resultado que la tecnología utilizada en la segunda etapa (cumpliendo ésta con los límites mínimos de detección). Según estos argumentos, los criterios para la definición de la tecnología a utilizar se basan en: – Límite de detección de la tecnología (criterio técnico) – Capacidad analítica del laboratorio para satisfacer demanda de análisis (criterio logístico).
Material y Método
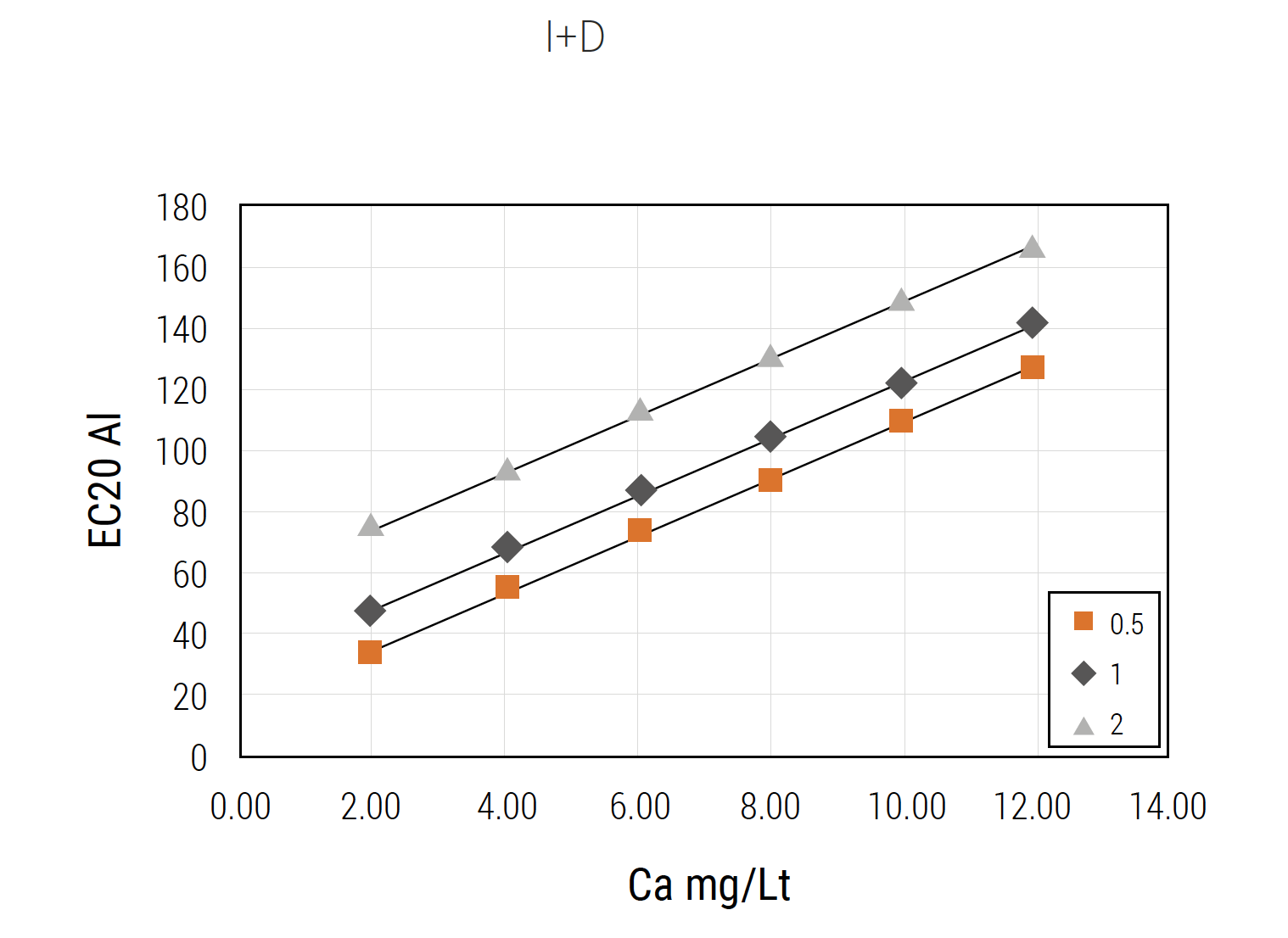
Figura 4. Umbral tóxico de aluminio (vía branquial) con bajos niveles de Ca y Mg a 3 concentraciones de TOC (0,5, 1,0 y 2,0 mg C/l)..
En la industria salmonicultora chilena, la definición de los límites de detecciónestá dada por el nivel de metal que ejerce un efecto tóxico en los peces. La Figura 4 muestra los niveles tóxicos estimados de Al (vía branquial) (criterios BLM (Biotic Ligand Model, (5). Se muestra la variación de toxicidad del Al en función del Ca (eje x) y tres niveles de Carbono Orgánico Total (TOC) (0,5, 1 y 2 mg C/Lt). Basándose en este criterio, se establece que desde concentraciones de Al total de 30 ug/Lt (aguas muy blandas, con nivel de Ca en torno a 2 mg/l) puede producirse toxicidad en peces. En aguas dulces típicas de nuestras regiones productoras el nivel tóxico se presenta con frecuencia entre 100 y 150 ug/l (Santore y col., 2018). Según lo descrito, se pueden definir las tecnologías capaces de cumplir con los límites para establecer efectos en peces. La Figura 5 muestra límites de detección de las tecnologías de ICP masa (Inducción de Plasma Acoplado con detector de masa) y la espectrofotometría de absorción electrónica..
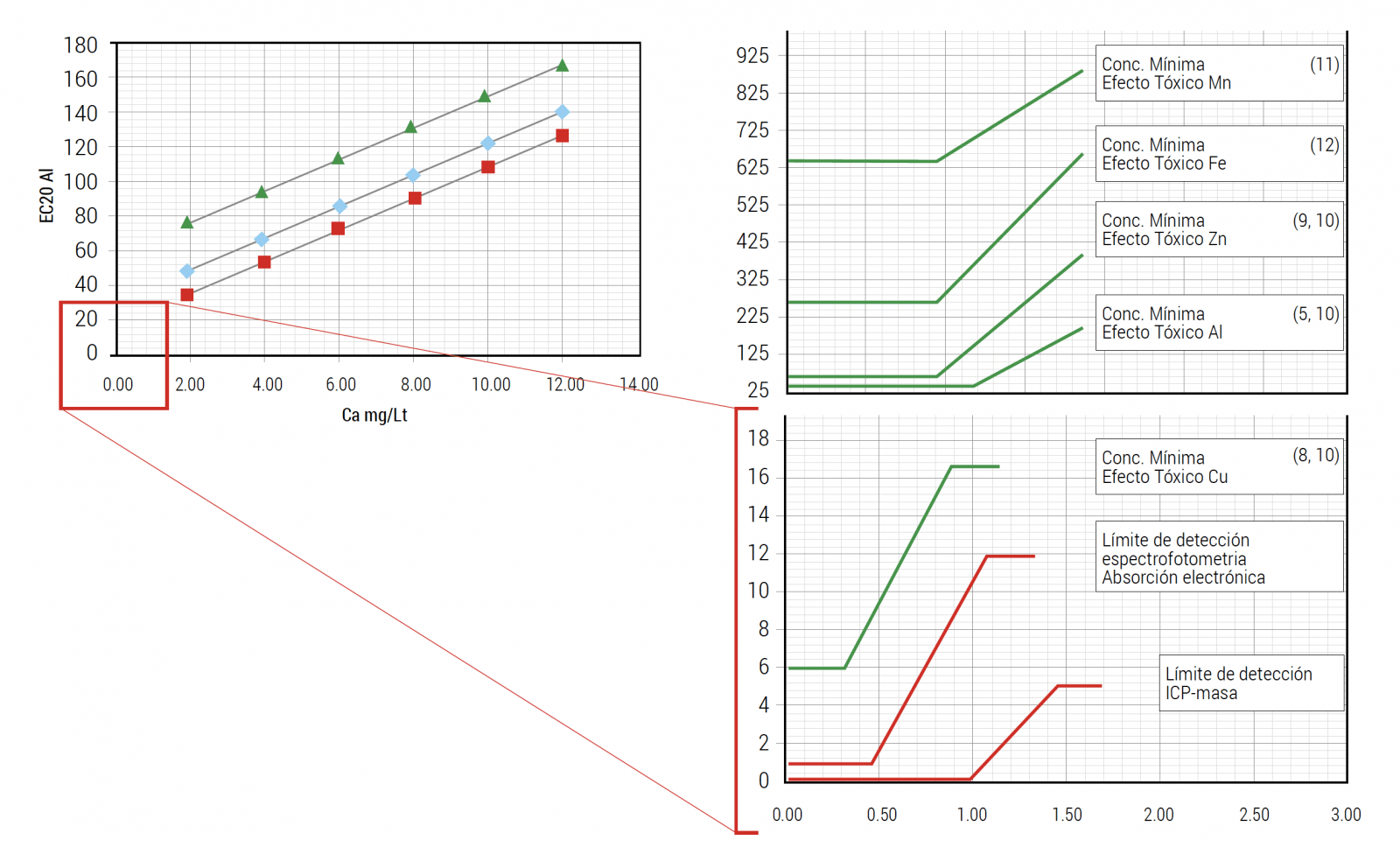
Figura 5. Rangos de detección mínimos en tecnologías de Espectrofotometría de Absorción Electrónica e ICP-Masa (líneas rojas). Se pone en contexto con los niveles mínimos de metales que ejercen efecto tóxico en peces (líneas verdes). Los límites tóxicos corresponden a los que resultan cuando el agua tiene mínimos niveles de Ca, Mg y TOC (no representativos de aguas naturales de Chile con contenido mineral alto y límites tóxicos también).
Considerando la figura 5 y las capacidades de detección, se validan ambas tecnologías para el análisis de metales en el marco de salud de peces, recalcando que la fase de procesamiento (extracción de muestra), es más relevante para obtener resultados confiables que no subestimen niveles de metales.
Toxicidad de metales enpeces: mecanismo de acción y sitios blanco.
Siempre se ha identificado la branquia como el sitio blanco de metales y causante de mortalidades en peces. Esta realidad existe en aguas donde hay bajo contenido mineral (especialmente Ca y Mg) y TOC. Así, el efecto tóxico de metales está muy circunscrito a la presencia de especies metálicas lábiles, con carga positiva. Esto tiene sentido porque los canales iónicos branquiales, para captación de cationes (Na+, K+, Ca2+, Mg2+, entre otros), son estructuras proteicas (Slepkov y col., 2005; Gao y Wheatly, 2007; Schild 2010) que se inhiben reversible o irreversiblemente por metales como Al3+, Cu2+, Fe3+, Zn2+, entre otros (Yu y col., 2007; Hwang y col., 2011). Los canales iónicos activos más conocidos son los llamados Canales Epiteliales de Sodio (ENaC por sus siglas en inglés),.
Intercambiadores de Hidrógeno Sódico (NHE, por sus siglas en inglés) y Canales Epiteliales de Calcio (ECaC, por sus siglas en inglés), que participan en el transporte de Na+ y Ca2+, y que a diferencia de la Na+/ K+ ATPasa, son apicales no basolaterales. La Figura 6 muestra un esquema de un ENaC cuyo funcionamiento depende de la energía (gasto de ATP y gradiente de protones). Esta gradiente de protones acopla osmorregulación con respiración. Consecuentemente, la presencia de metales no solo afecta la osmorregulación, sino también la respiración (participación de Anhidrasa Carbónica (Hwang y col., 2011)). Así, la semejanza entre los metales (forma lábil) y el sodio, producen inhibición de los canales iónicos (competitiva o irreversible) (Yu y col., 2007) (Figura 6). Esto explica que los modelos de toxicidad se basan en presencia de metales lábiles y la branquia como blanco único. En Chile se ha observado (Pessot 2017c) que la concentración de Al y sus formas químicas producen toxicidad no solo a nivel branquial, sino principalmente en riñón (muy presente en pisciculturas de recirculación). Este mecanismo es una ingestión de metales donde la acidez (pH) gástrica (peces) transforma las formas químicas no lábiles de metales en formas químicas lábiles. El efecto de los metales sobre el riñón se explica mejor porque los órganos y/o tejidos con mayor concentración de canales epiteliales para iones (ENaC, ECaC, NHE, entre otros) en peces son la branquia y el riñón (función osmorregulatoria y excretora).
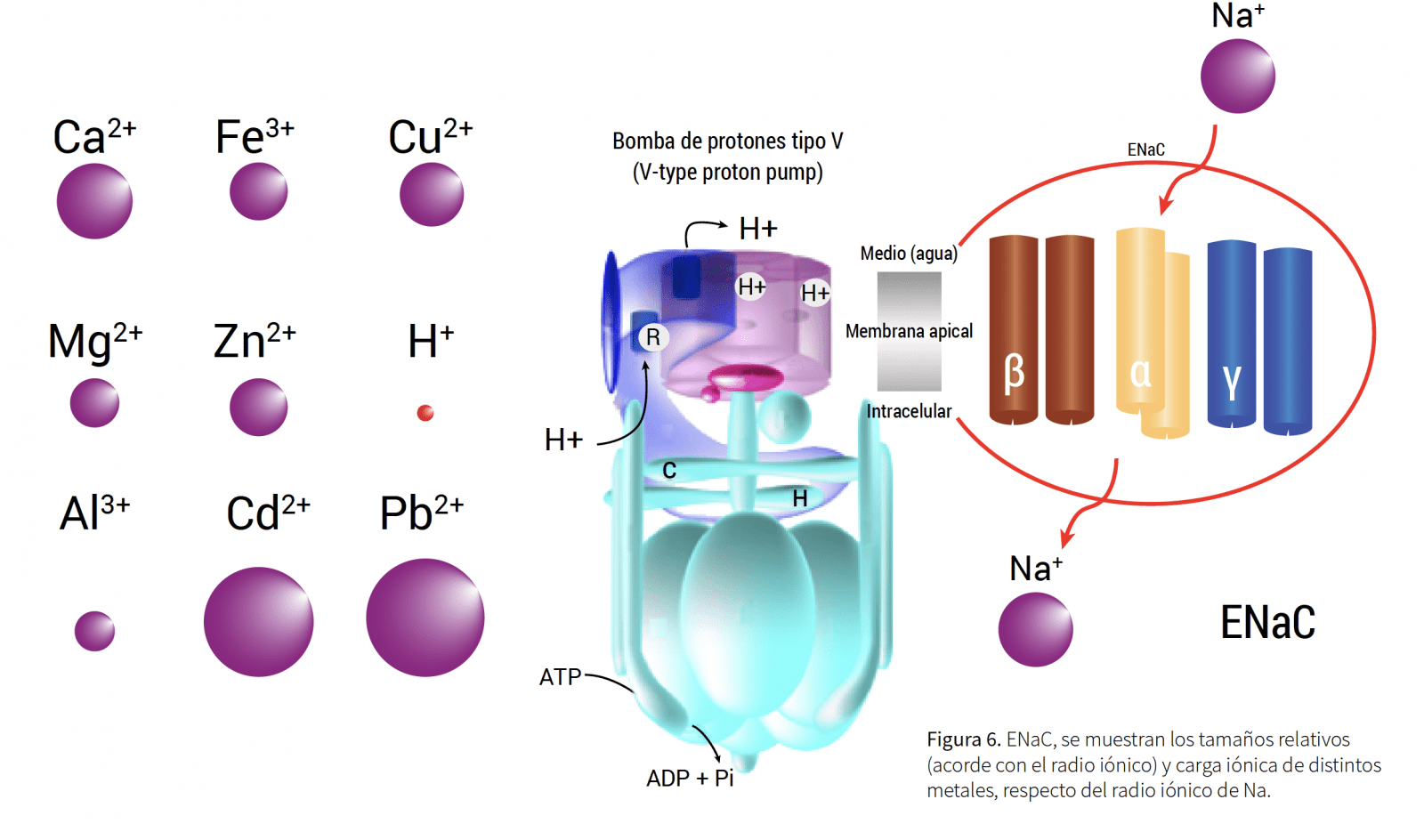
Figura 6. ENaC, se muestran los tamaños relativos (acorde con el radio iónico) y carga iónica de distintos metales, respecto del radio iónico de Na.
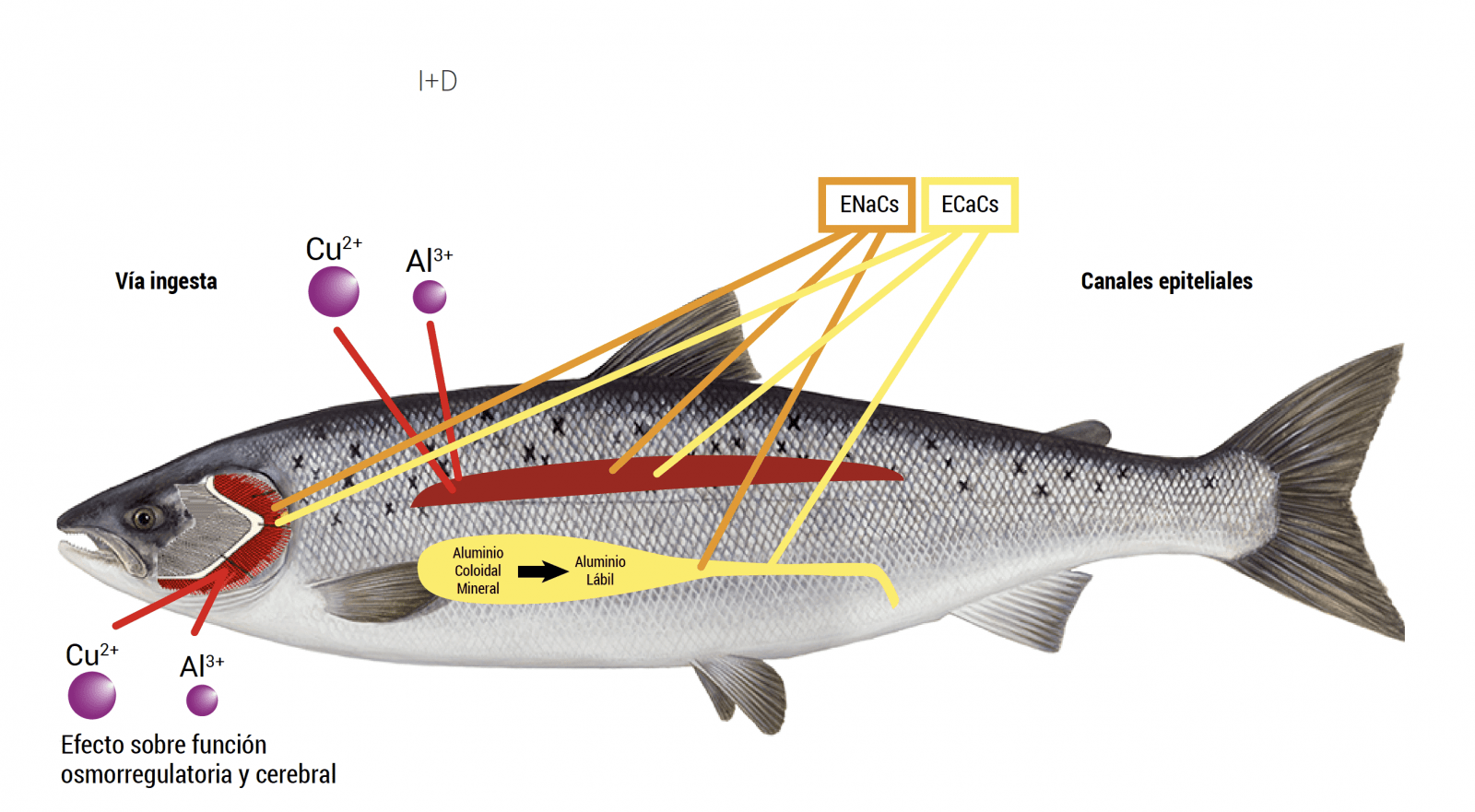
Figura 7. Transformación química de metales (aluminio) a nivel intestinal. Branquia y riñón órganos con mayor concentración de canales iónicos (sitios blanco de metales).
Esto explica resultados obtenidos (Pesssot 2017c; Pessot y Sandoval, 2017) en Chile, donde el sitio blanco del Al, en el menor de los casos es la branquia. Así se ha desestimado el efecto del Al considerando erróneamente la presencia de otro agente tóxico (desconocido). Resultados de análisis de metales en agua y tejido de peces han generado una importante base de datos que acumula resultados de metales en tejidos de peces en la industria salmonicultora chilena. Esta permite establecer rangos de niveles de metales en peces sanos (0,180 hasta 1,5 grs), y correlacionar la signología de peces enfermos con niveles altos de Al a nivel renal y ausencia del metal a nivel branquial. Esto porque las formas de Al (no lábiles), no interfieren en canales iónicos, pero sí lo hacen luego de digestión a nivel gástrico (acidez, bajo pH). La Figura 8 muestra resultados de metales en tejido de peces sanos y enfermos, y promedios de la base de datos para dicho metal en los tejidos estudiados (Pessot y Sandoval, 2017).
Debemos replantearnos los mecanismos de metales que afectan la salud de los peces en Chile. La visión tradicional, donde solo la branquia es afectada, lleva implícito un efecto agudo correlacionado a aumentos súbitos de metales en el agua. Sin embargo, un mecanismo en el que el riñón pondera tanto o más que la branquia, sugiere que los cuadros de toxicidad incluyen una dinámica acumulativa en la que los efectos tóxicos son detectables cuando la concentración de Al llega a un umbral en que los canales iónicos en el tejido renal (Túbulo proximal, Nefrón distal, túbulo conector cortical) son saturados. Como esta acumulación se produce en el mediano plazo, no necesariamente se encontrará una correlación entre nivel de Al en el agua al momento de presentarse un cuadro de mortalidad. Si las formas metálicas no son necesariamente lábiles entonces también hay formas no disueltas coloidales, minerales o asociadas a materia orgánica no disuelta. Este último caso corresponde a microparticulado sólido que puede
ser ingerido por el pez. Como en este modelo las formas metálicas presentes en el medio acuático pierden relevancia, surgen otros aspectos importantes que no han sido considerados y que combinan la composición fisicoquímica del agua con el manejo y diseño de factores hidráulicos en las pisciculturas.
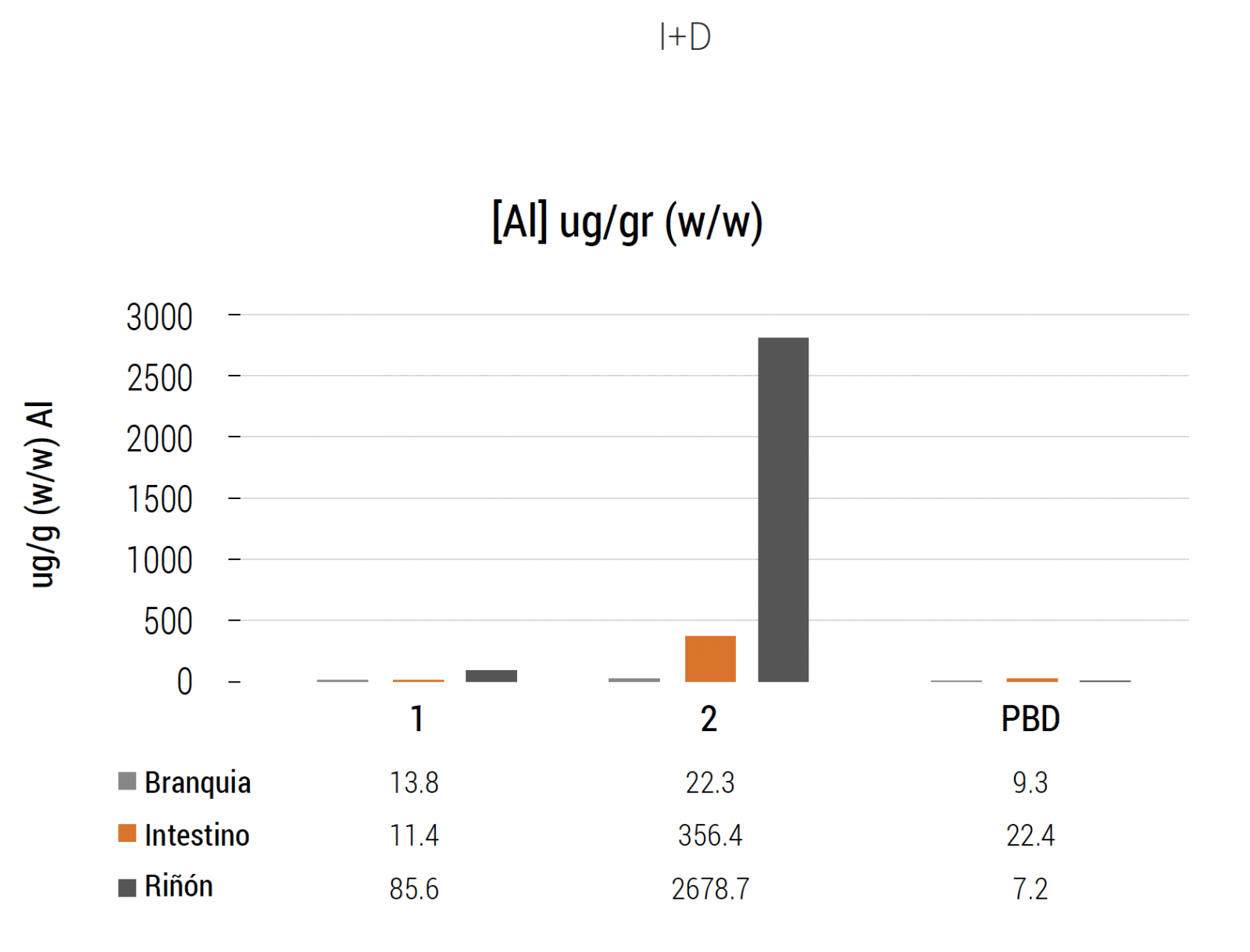
Figura 8. Concentración de aluminio detectada en branquia, intestino y riñón. Grupo sano (1), grupo conmortalidad (2) y promedios de peces sanos de base de datos (PBD).
Factores hidráulicos en pisciculturas y su relación con el efecto tóxico de metales
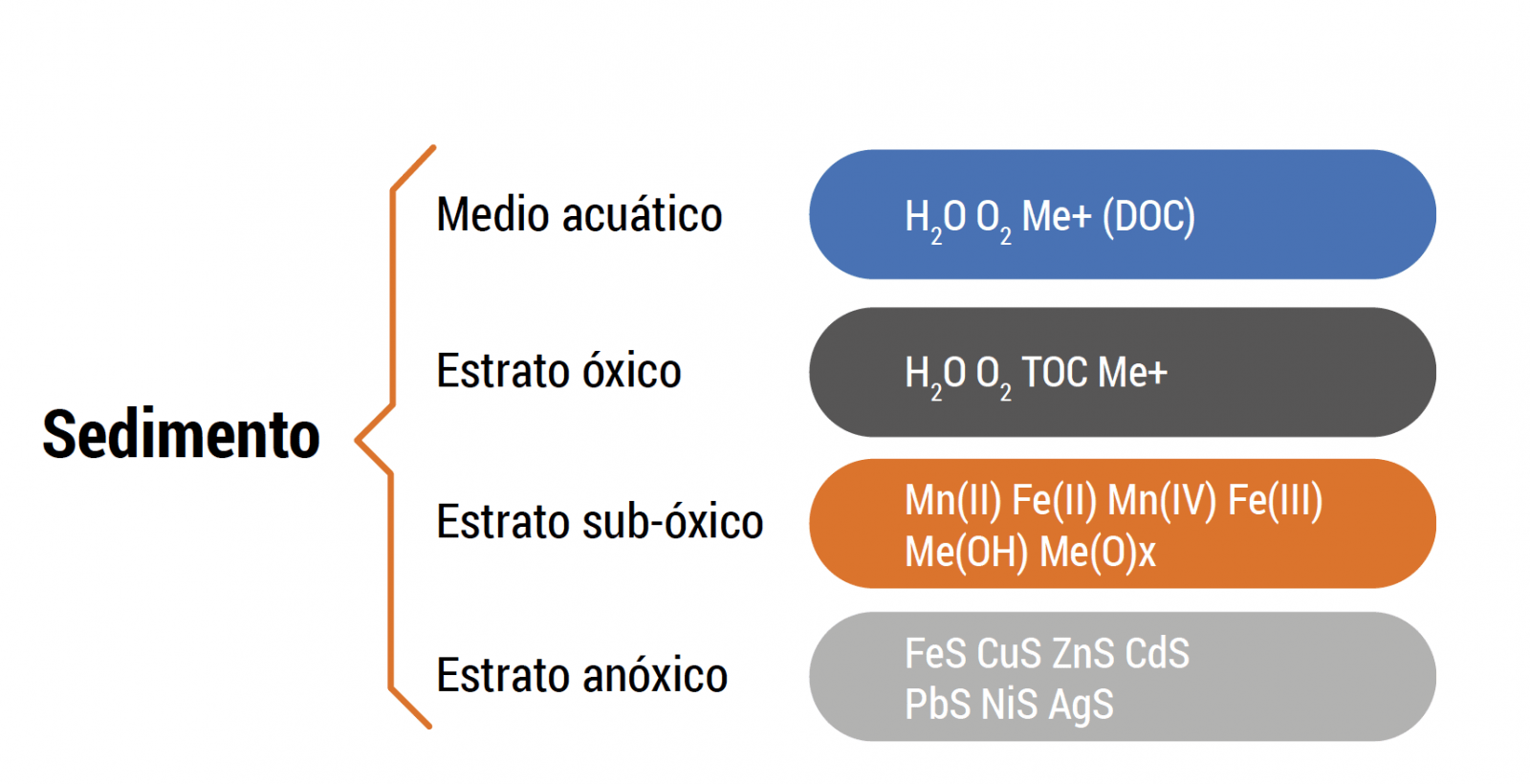
Figura 9. Estratificación de metales según el tipo de sedimento. Acumula Cu, Zn, Cd, Pb, Ni y Ag entre otros en los sectores anóxicos; Mn, Fe en sectores intermedios, y Al solo en sectores óxicos.
Dado que la presencia de metales en formas químicas complejas no disueltas es parte de la causa de mortalidad en sistemas productivos, a la complejidad de la dinámica de toxicidad de metales se suman otras macrovariables que guardan relación con el campo de la ingeniaría. En este caso juegan roles importantes factores de tipo físico (hidráulicos), junto con la calidad fisicoquímica del agua. Estos factores hidráulicos (fuera de material en suspensión) se refieren a la capacidad de mantener sistemas donde predominen flujos laminares, evitando zonas muertas con nulo recambio. Estudios previos (Pessot y Sandoval, 2017) demuestran que la deficiencia de flujo laminar produce una compartimentalización (acumulación) de metales, siendo muy dependiente del tipo de sistema (flujo abierto o recirculación) y del tipo de agua que se utilice. Esto es crítico en pisciculturas de recirculación que utilizan agua de mar dado que ésta es un vector con mayor concentración de metales.
Al combinar factores hidráulicos con aspectos fisicoquímicos de agua y efectos adversos dados por metales, la presencia de sectores anóxicos es crítica. Dependiendo de esto se acumularán distintos tipos de metales (Pessot y Sandoval, 2017). La Figura 9 muestra la estratificación y tipo de metales que se acumulan dependiendo de la condición de oxigenación (Jorgensen y Revsnech, 1985; Ward y col., 2012). En el caso de pisciculturas que utilizan agua de mar, los estratos anóxicos, como los que muestra la Figura 9 son un factor de riesgo importante. En este tipo de formaciones químicas la fuerza iónica aportada por el agua de mar, que mantiene bajos o controlados los stocks de metales en las biomasas (en el estrato óxicos, como es el biofiltro), deja de ser un factor de protección. Estudios de Aquaknowledge en pisciculturas de recirculación en Chile (Pessot y Sandoval, 2017) demuestran que existe correlación entre nivel de sulfuros en sedimentos y distintos tipos de metales. Esto demostró que el Al se presenta solo en sedimentos sin sulfuros,
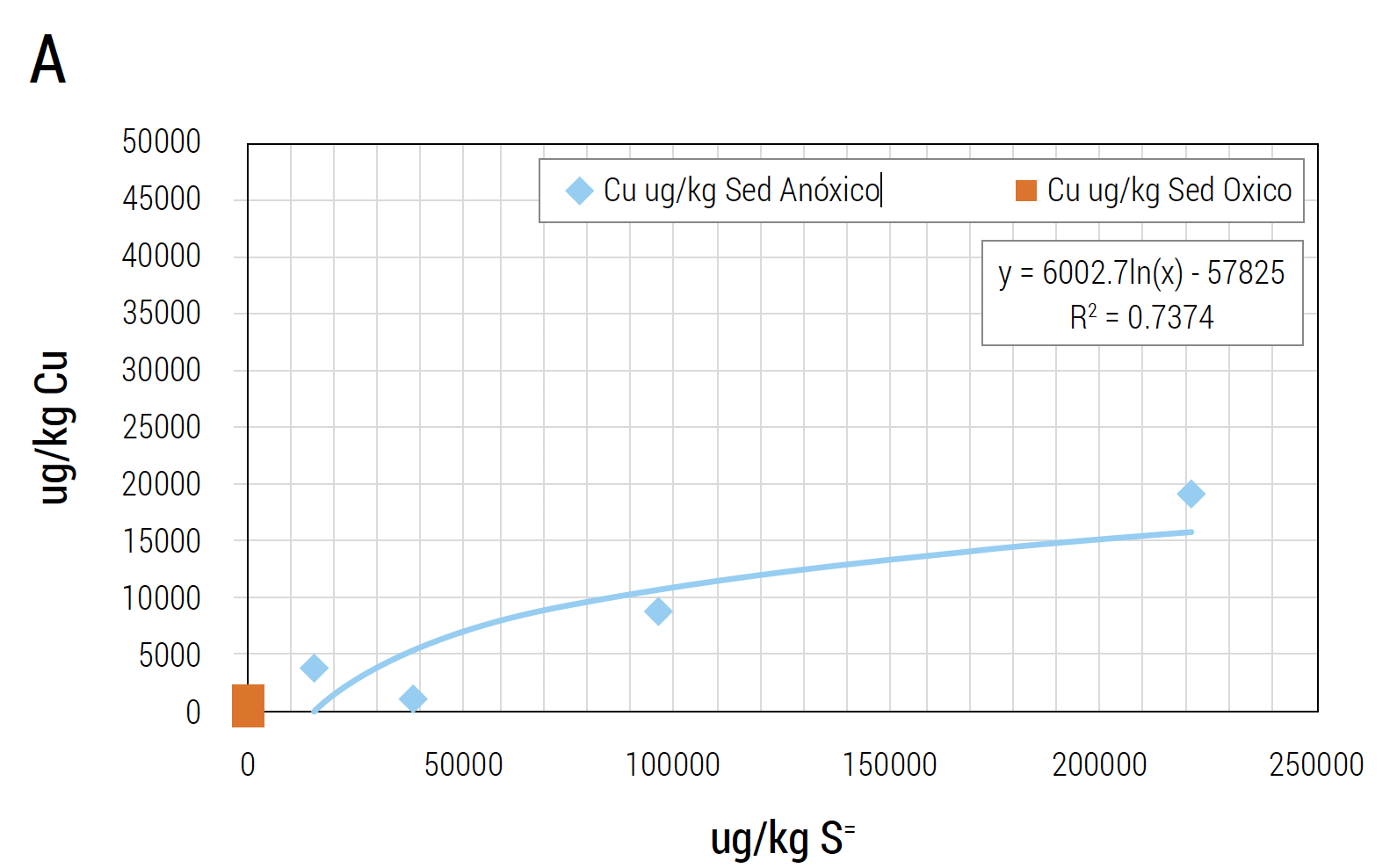
y que otros metales están presentes en función de la concentración de sulfuros. Las concentraciones de Cobre (Cu), Hierro (Fe) y Al aumentan o disminuyen en función del nivel de sulfuro en el sedimento (Pessot y Sandoval, 2017) (Figura 10 (A, B y C)).
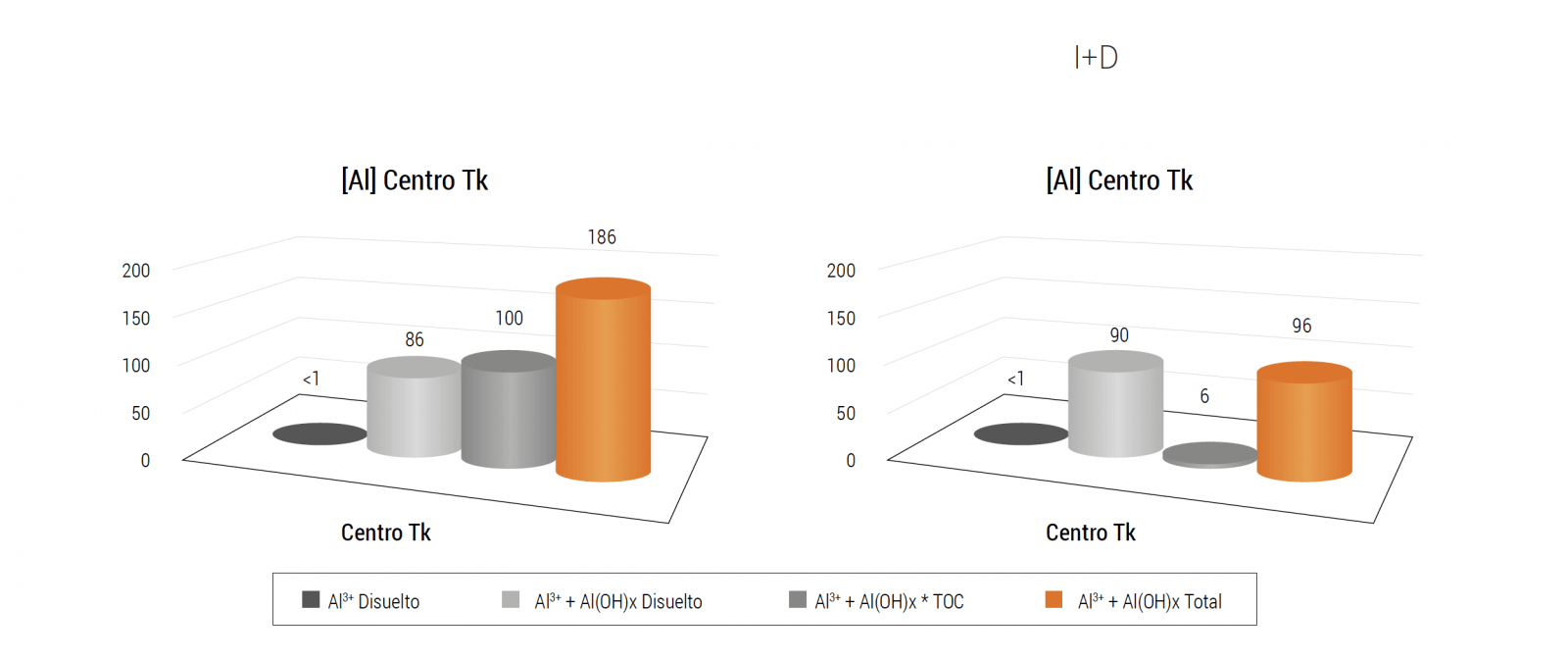
Dado que el comportamiento de los distintos metales es diferente, las soluciones técnicas (hidráulicas) deben ser diferentes según el metal que resulte causa de problemas. Cuando se trata de Al, la casuística observada apunta mayormente a la hidráulica de los estanques. Resultados de análisis (especiación) de Al en estanques muestran una distribución no uniforme concentrándose en su centro (Figura 11). La mortalidad asociada a Al ya ha sido resuelta en varios sistemas abordando factores hidráulicos donde las formas lábiles no son las que se presentan en mayor concentración.
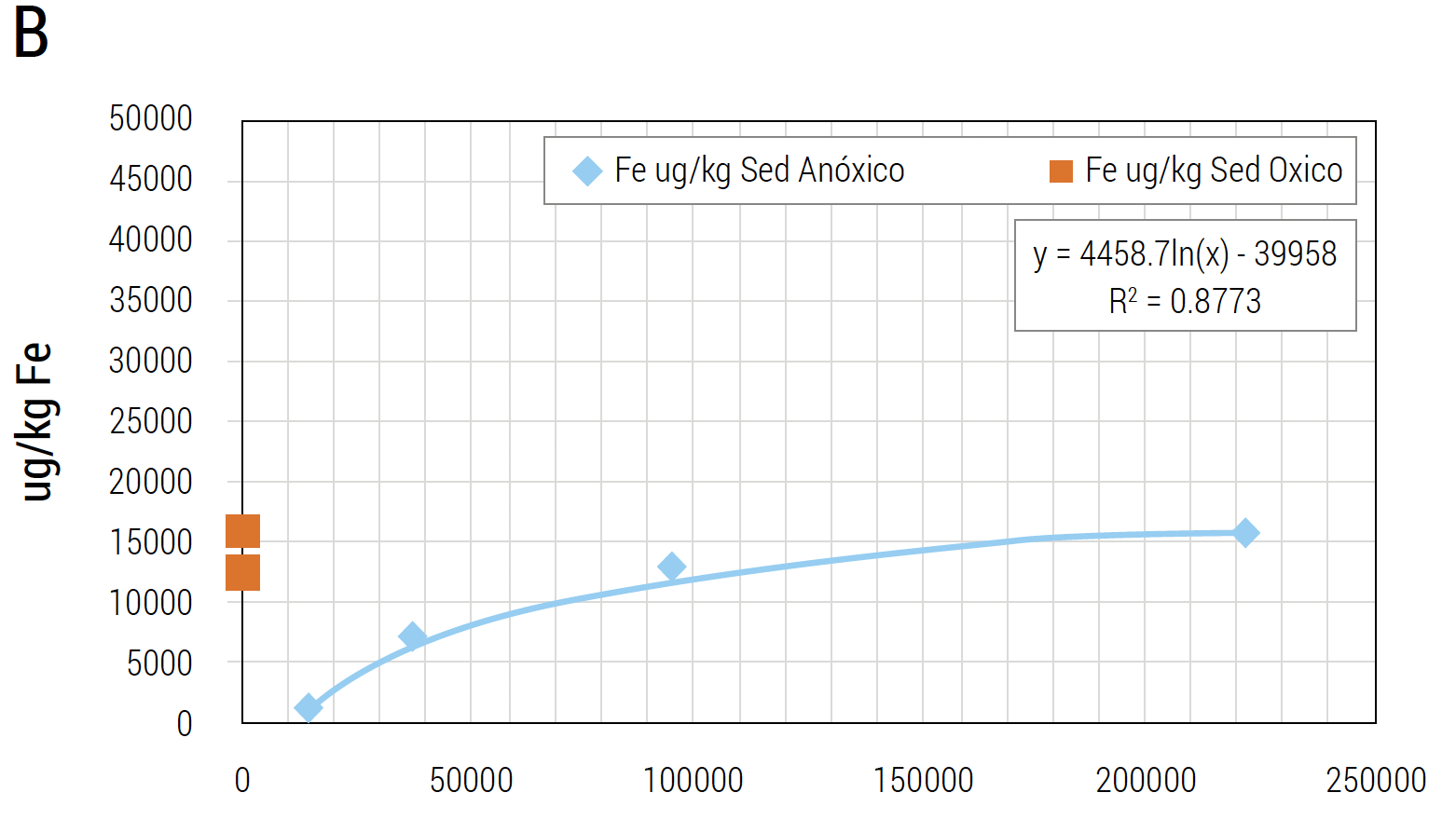
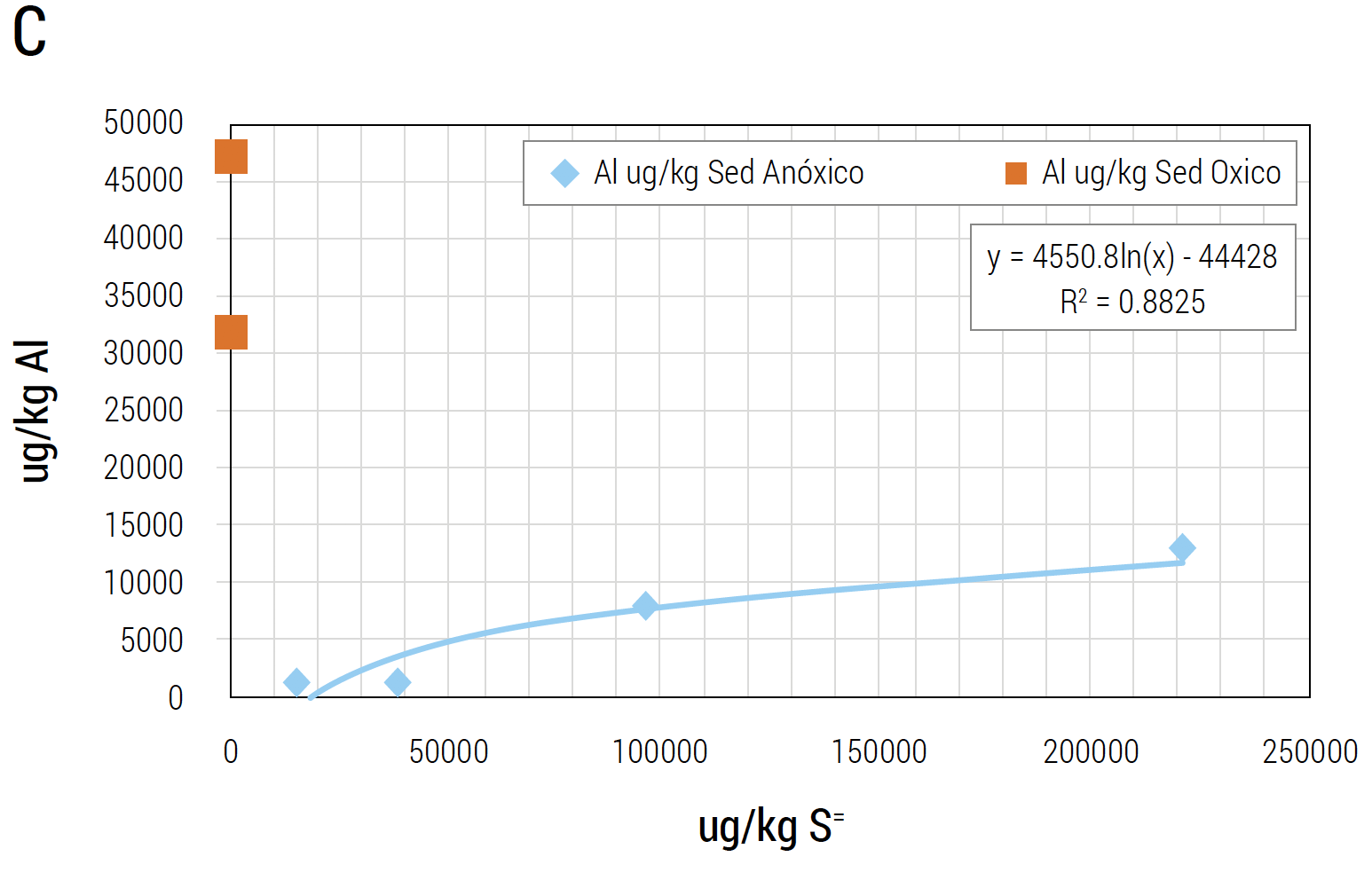
Figura 10 A, B y C. Ácido sulfhídrico y metales (Al, Cu y Fe) por masa (peso húmedo) de sedimento. Se correlaciona concentración de ácido sulfhídrico (ug/kg de sedimento) con nivel de metales (ug/kg de sedimento). La concentración de metales es dependiente del tipo de sedimento siendo el Al el que está en mayor concentración en sedimentos tóxicos.
Discusión
Los problemas de eficiencias productivas asociados a mortalidad en pisciculturas (recirculación y flujo abierto), han sido por largo tiempo materia de estudio. Si bien se ha asignado a la presencia de metales en el agua esta condición, hasta ahora no se había identificado causas específicas que permitan identificar en nuestra industria condiciones particulares no presentes fuera de Chile. Aquí se establece con mayor precisión que el Al sigue siendo el mayor problema actual de índole productivo en pisciculturas (flujo abierto y recirculación) y que el mecanismo de acción bioquímico es muy diferente al propuesto hasta la fecha. Si bien el mecanismo propuesto a la fecha (toxicidad por vía branquial) puede ser válido en aguas blandas, en general este no explica los efectos adversos y mortalidades observadas en nuestras instalaciones. El desarrollo de pisciculturas de recirculación, sumado al cambio climático, han creado condiciones en que se suman un incremento del input de metales dado por afluentes y factores hidráulicos. Así el nivel.
ambiental de ciertos metales (como Al) es comparativamente alto presentándose en formas complejas que, digeridas a nivel intestinal, afectan la función renal. Las altas fluctuaciones de composición fisicoquímica de los cuerpos de agua natural a través del período anual igualmente terminan siendo un factor de inestabilidad que se suma a la propia dinámica de los sistemas productivos. Los antecedentes no publicados muestran que no solo el Aluminio puede estar comportándose en forma inestable y en altas concentraciones, sino también otros metales que pueden estar actuando en forma sinérgica.